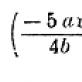Свойства оксидов и гидроксидов марганца. Соединения марганца (II), (III), (IV), свойства оксидов и гидроксидов, соли марганца, их свойства; диоксид марганца, его свойства Оксид марганца 4 плюс
MnО, Mn 2 О 3 , MnО 2 , Mn 3 О 4 , Mn 2 О 7 , Mn 5 О 8 . Кроме Mn 2 О 7 , все оксиды - кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды:
При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn 2 О 3 окисляются до MnО 2 . Безводные и гидратир. оксиды Mn входят в состав марганцевых и железо-марганцевых руд в виде минералов пиролюзита b-MnО 2 , псиломелана mМО.nMnО 2 .хН 2 О [М = Ва, Са, К, Mn(Н)], манганита b-MnOOH (Mn 2 О 3 .Н 2 О), гроутита g-MnOOH, браунита 3Mn 2 O 3 .MnSiO 3 и др. с содержанием MnО 2 60-70%. Переработка марганцевых руд включает мокрое обогащение и послед. хим. выделение оксидов MnО 2 или Mn 2 О 3 методами сульфитизации и сульфатизации, карбонизации, восстановит. обжига и др. Монооксид MnО (минерал манганозит). До Ч 155,3 °С устойчива гексагoн. модификация, выше - кубическая (см. табл.). Полупроводник. Антиферромагнетик с точкой Нееля 122 К; магн. восприимчивость + 4,85.10 - 3 (293 К). Обладает слабоосновными св-вами; восстанавливается до Mn водородом и активными металлами при нагревании. При взаимод. MnО с к-тами образуются соли Mn(II), с расплавом NaOH при 700-800°С и избытке O 2 - Na 3 MnO 4 , при действии (NH 4) 2 S - сульфид MnS. Получают разложением Mn(OH) 2 , Mn(C 2 O 4), Mn(NO 3) 2 или MnСО 3 в инертной атмосфере при 300 °С, контролируемым восстановлением MnО 2 или Mn 2 О 3 водородом или СО при 700-900 °С. Компонент ферритов и др. керамич. материалов, шлака для десульфуризации металлов, микроудобрений, катализатор дегидрогенизации пиперидина, антиферромагн. материал. Сесквиоксид Mn 2 О 3 существует в двух модификациях - ромбич. a (минерал курнакит) и кубич. b (минерал биксбиит), т-ра перехода a: b 670 °С; парамагнетик, магн. восприимчивость +1,41Х10 - 5 (293 К); восстанавливается Н 2 при 300°С до MnО, алюминием при нагр. - до Mn. 
Под действием разб. H 2 SO 4 и HNO 3 переходит в MnО 2 и соль Mn(II). Получают Mn 2 О 3 термич. разложением MnООН. Оксид марганца (II, III) Mn 3 О 4 (минерал гаусманит); a-Mn 3 О 4 при 1160°С переходит в b-Mn 3 О 4 с кубич. кристаллич. решеткой; DH 0 перехода a: b 20,9 кДж/моль; парамагнетик, магн. восприимчивость + 1,24.10 - 5 (298 К). Проявляет хим. св-ва, присущие MnО и Mn 2 О 3 . Диоксид MnО 2 - самое распространенное соед. Mn в природе; наиб. устойчива b-модификация (минерал пиролюзит). Известны ромбич. g-MnО 2 (минерал рамсделит, или полианит), а также a, d и e, рассматриваемые как твердые р-ры разл. форм MnО 2 . Парамагнетик, магн. восприимчивость + 2,28.10 - 3 (293 К). Диоксид Mn - нестехиометрич. соед., в его решетке всегда наблюдается недостаток кислорода. Амфотерен. Восстанавливается Н 2 до MnО при 170°С. При взаимод. с NH 3 образуются Н 2 О, N 2 и Mn 2 О 3 . Под действием О 2 в расплаве NaOH дает Na 2 MnO 4 , в среде конц. к-т - соответствующие соли Mn(IV), H 2 O и О 2 (или Cl 2 в случае соляной к-ты). Получают MnО 2 разложением Mn(NO 3) 2 или Mn(ОН) 2 при 200°С на воздухе, восстановлением КMnО 4 в нейтральной среде, электролизом солей Mn(II). Применяют для получения Mn и его соед., сиккативов, как деполяризатор в сухих элементах, компонент коричневого пигмента (умбры) для красок, для осветления стекла, как реагент для обнаружения Cl - , окислитель в гидрометаллургии Zn, Cu, U, компонент катализатора в гопкалитовых патронах и др. Активный MnО 2 , получаемый взаимод. водных р-ров MnSO 4 и КMnО 4 , -окислитель в орг. химии. Оксид марганца (VII) Mn 2 О 7 (гептаоксид димарганца, марганцевый ангидрид) - маслянистая зеленая жидкость; т. пл. 5,9 °С; плотн. 2,40 г/см 3 ; DH 0 обр -726,3 кДж/моль. Выше 50 °С при медленном нагревании начинает разлагаться с выделением О 2 и образованием низших оксидов, а при более высоких т-рах или высоких скоростях нагревания взрывается; крайне чувствителен к мех. и тепловым воздействиям. Сильный окислитель; при контакте с Mn 2 О 7 горючие в-ва воспламеняются. М. б. получен при взаимод. КMnО 4 с H Z SO 4 на холоду. Оксид Mn 5 О 8 , или Mn 2 II (Mn IV О 4) 3 , - твердое в-во; не раств. в воде; м. б. получен окислением MnО или Mn 3 О 4 ; легко разлагается на MnО 2 и О 2 . Из гидроксидов Mn стехиометрич. соед. являются только Mn(ОН) 2 , MnО(ОН) и НMnО 4 , другие представляют собой гидратир. оксиды переменного состава, близкие по хим. св-вам соответствующим оксидам. Кислотные св-ва гидроксидов увеличиваются с возрастанием степени окисления Mn: Mn(ОН) 2 < MnО(ОН) (или Mn 2 O 3 .xH 2 O) < MnO 2 .xН 2 О < Mn 3 О 4 .xН 2 О < Н 2 MnО 4 < НMnО 4 . Гидроксид Мn(II) практически не раств. в воде (0,0002 г в 100 г при 18 °С); основание средней силы; раств. в р-рах солей NH 4 ; на воздухе постепенно буреет в результате окисления до MnО 2 .xН 2 О. Гидроксиоксид Mn(III) MnO(OH) известен в двух модификациях; при 250 °С в вакууме обезвоживается до g-Mn 2 О 3 ; в воде не раств. Прир. манганит не разлагается HNO 3 и разб. H 2 SO 4 , но медленно реагирует с H 2 SO 3 , искусственно полученный легко разлагается минер. к-тами; окисляется О 2 до b-MnО 2 . См. также Манганаты.
М. о. токсичны; ПДК см. в ст. Марганец.
Лит.:
Позин М. Е.. Технология минеральных солей, 4 изд., ч. 1 2, Л., 1974. П. М. Чукуров.
- - Железобактерии известны очень давно...
Биологическая энциклопедия
- - сернокислый марганец, MnSO4, марганцевое микроудобрение. Кристаллич. в-во, растворимое в воде...
Сельско-хозяйственный энциклопедический словарь
- - MnСО 3, бледно-розовые кристаллы, в присут. О 2 и Н 2 О приобретают коричневый оттенок вследствие окисления; кристаллич. решетка гексагональная; плотн. 3.62 г/см 3; С 0p 94,8 Дж/; DH0 обр -881,7 кДж/моль; S0298109,5 Дж/...
Химическая энциклопедия
- - Декакарбонилдимарганец Mn2 10 - золотисто-желтые кристаллы; т. пл. 154 155°С; плотн. 1,75 г/см 3. Медленно разлагается на свету, разлагается на воздухе при 110 °С, сублимируется в вакууме при 50 °С. Раств...
Химическая энциклопедия
- - Mn2, бледно-розовые гигроскопичные кристаллы с кубич. решеткой; DH0 обр Ч574,6 кДж/моль. Разлагается выше 180°С до оксидов Mn. Р-римость в воде: 102,0 , 157,1 , 428,0 и 498,8 . Раств. также в диоксане, ТГФ, ацетонитриле...
Химическая энциклопедия
- - MnSO4, имеет т. пл. 700°С; С° р 100,24 Дж/; DG0 обр -958,11 кДж/моль; ниже 11 К антифсрромагнетик, выше 11 К парамагнетик, магн. восприимчивость + 1,366.10-6 ; см. также табл. Ок. 850°С разлагается на Mn3O4, SO3 и SO2...
Химическая энциклопедия
- - соединения хим. элементов с кислородом. Делятся на солеобразующие и несолеобразующие. Солеобразующие бывают основными, кислотными и амфотерными - их гидраты являются соотв...
Естествознание. Энциклопедический словарь
- - неорганические соединения, в которых КИСЛОРОД связан с другим элементом. Оксиды часто образуются при горении элемента на воздухе или в присутствии кислорода. Так, магний при горении образует оксид магния...
Научно-технический энциклопедический словарь
Диоксид марганца (МnО 2) или оксид марганца (IV) — вещество темно-серого цвета. При нагревании на воздухе до 530 град. С диоксид марганца разлагается, выделяя кислород, как показано выше. В вакууме или в присутствии восстановителя эта реакция протекает значительно интенсивнее.
При кипячении диоксида марганца с концентрированной азотной кислотой образуется соль марганца (II) и выделяется кислород:
2 МnО 2 + 4 НNО 3 = 2 Мn(NО 3) 2 + 2 Н 2 О + O 2 .
Диоксид марганца в кислой среде проявляет окислительные свойства:
МnО 2 + 4 НСl = МnСl 2 + Сl 2 + 2 Н 2 О;
МnО 2 + 2 FеSO 4 + 2 Н 2 SO 4 = МnSO 4 + Fе 2 (SO 4) 3 + 3 Н 2 О.
При сплавлении оксида марганца (IV) со щелочами без доступа воздуха образуется манганит или манганат (IV):
2 МnО 2 + 2 КОН = К 2 МnО 3 + Н 2 О.
В присутствии кислорода воздуха, играющего роль окислителя, при сплавлении образуется соль манганата (VI):
2 МnО 2 + 4 КОН + O 2 = 2 К 2 МnО 4 + 2 Н 2 О.
Манганат калия (К 2 МnO 4) самопроизвольно разлагается на перманганат калия и диоксид марганца:
3 К 2 МnО 4 + 2 Н 2 О = 2 КМnО 4 + МnО 2 + 4 КОН.
Перманганат калия (КМnO 4) широко применяется в лабораторной практике, промышленности, медицине и быту. Он является очень сильным окислителем. В зависимости от среды марганец в присутствии восстановителя может восстанавливаться до различной степени окисления. В кислой среде он всегда восстанавливается до Mn (II):
2 КМnО 4 + 10 КВr + 8 Н 2 SO 4 = 2 МnSO 4 + 6 К 2 SO 4 + 5 Вr 2 + 8 Н 2 О.
Аналогично ведут себя манганат калия (К 2 МnО 4) и диоксид марганца.
В щелочной среде перманганат калия восстанавливается до манганата:
2 КМnО 4 + К 2 SO 3 + 2 КОН = К 2 SO 4 + 2 К 2 МnO 4 + Н 2 О.
В нейтральной или слабощелочной среде перманганат калия восстанавливается до диоксида марганца:
2 КМnО 4 + С 6 Н 5 СН 3 = 2 КОН + 2 МnО 2 + С 6 Н 5 СООН;
2 КМnО 4 + 3 МnSO 4 + 2 Н 2 О = 5 МnО 2 + К 2 SО 4 + 2 Н 2 SО 4 .
Последняя реакция используется в аналитической химии при количественном определении марганца.
Раньше перманганат калия получали окислением либо диоксида марганца, либо манганата калия. Диоксид марганца окисляли селитрой при сплавлении со щелочью:
МnО 2 + КNО 3 + 2 КОН = К 2 МnО 4 + КNО 2 + Н 2 О.
Образовавшийся манганат калия в растворе самопроизвольно распадался на перманганат калия и диоксид марганца:
3 К 2 MnО 4 + 2 Н 2 О = 2 КМnО 4 + MnО 2 + 4 КОН.
По второму способу манганат калия окисляли хлором:
2 К 2 МnО 4 + Сl 2 = 2 КМnО 4 + 2 КСl.
В настоящее время перманганат калия получают электролитическим окислением манганата:
МnO 4 2- — е — = МnO 4 — .
Перманганат калия широко применяется как в промышленности, так и в лабораторной практике. Его используют для отбеливания хлопка, шерсти, прядильных волокон, осветления масел и окисления различных органических веществ. В лабораторной практике он применяется для получения хлора и кислорода:
2 КМnO 4 + 16 НСl = 2 КСl + 2 МnСl 2 + 5 Cl 2 + 8 Н 2 О;
2 КМnО 4 = К 2 МnО 4 + МnО 2 + O 2 .
В аналитической химии перманганат калия применяют для количественного определения веществ, обладающих восстановительными свойствами (Fе 2+ , Sn 2+ , АsО 3 3+ , Н 2 О 2 , и др.). Этот метод анализа называется перманганатометрией.
Алюминотермическим методом, восстанавливая оксид Mn 2 O 3 , образующийся при прокаливании пиролюзита: ;
Мn 6+ диспропорционирует на MnO 2 и MeMnO 4 .
Mn 3+ диспропорционирует на Mn 2+ и MnO 2 (тв.)
Оксиды:
Известны оксиды марганца, в которых он находится в степенях окисления +2, +3, +4, +7, а также несколько смешанных, например Мn 3 0 4 . При увеличении степени окисления возрастает ковалентный характер связи Мn-О, происходит ослабление основных и усиление кислотных свойств, повышение окислительной активности. Так, оксид марганца(2) проявляет основные и преобладающие восстановительные свойства, а высший оксид марганца имеет кис
лотный характер. У него ярко выражены окислительные свойства. Оксиды марганца в промежуточных степенях окисления амфотерные и легко восстанавливаются до Mn(II), проявляя свойства сильных окислителей.
Оксид марганца(2). Низший оксид МnО представляет собой серо-зеленый кристаллический порошок со структурой NaCl. Он встречается в природе в виде минерала манганозита. Его
реакционная способность зависит от размера зерен. Высокодисперсная форма оксида, образующаяся при низкотемпературном разложении (420 -450 °С) карбоната, оксалата или ацетата марганца(П), обладает значительной химической активностью - воспламеняется на воздухе. Ее прокаливание в инертной атмосфере приводит к укрупнению зерен и ослаблению химической активности. Для получения фазы стехиометрического состава проводят восстановление оксидов Мn 3 0 4 и Мn0 2 водородом при высоких температурах. Низший оксид марганца может быть также получен при взаимодействии марганца
с углекислым газом при температуре 300 "С, восстановлении или прокаливании других оксидов марганца, а также при обезвоживании гидроксида Мn(ОН)2 в восстановительной атмосфере при 800 °С.
Оксид марганца(2) обладает преимущественно основным характером. Он легко растворяется в кислотах с образованием солей двухвалентного марганца. Слабая амфотерность проявляется лишь при
длительном кипячении с концентрированными растворами щелочей:
МпО + 20Н - + Н 2 0= 4[Мn(ОН) 4 ] 2- Сплавление с гидроксидом натрия приводит к окислению марганца: МnО + 2NaOH = Na 2 Mn0 3 + H 2
Оксид марганца(2) практически не восстанавливается водородом, зато реагирует с активными металлами. Реакция с натрием протекает уже при комнатной температуре, а для проведения алюмотермии требуется инициирование зажигательной смесью. В качестве восстановителя могут быть использованы также углерод или угарный газ.
Оксид марганца(2) является сильным восстановителем - при повышенных температурах он реагирует даже с таким слабым окислителем, как оксид углерода(4).
Оксид марганца(3). Оксид Мn 2 0 3 представляет собой бурый
порошок, при нагревании разлагающийся. при хранении на воздухе он медленно окисляется до оксида марганца(4), а в эвтектическом расплаве NaOH -КОН (227 °С) кислород переводит его в
манганат(5). Оксид марганца(3) с водой не взаимодействует, а в кислой среде диспропорционирует.
Подобно низшему оксиду марганца он обладает преимущественно основным характером, но при определенных условиях проявляет некоторые признаки амфотерности. Так, при длительном кипячении с растворами щелочей образуются анионные гексагидроксоманганаты(3) [Мn(ОН) 6 ] 3- , которые существуют только в сильнощелочной среде. Окислительные свойства Мn 2 0 3 проявляет при кипячении с концентрированной соляной кислотой.
Оксид марганца(4). Для марганца это наиболее часто встречающийся в природе минерал пиролюзит Мn0 2 . Среди многочисленных реакций образования Мn0 2 только некоторые предпочтительны благодаря легкости проведения и воспроизводимости. К ним относятся окисление соединений марганца(2) растворами хлоратов, перманга-
натов, персульфатов, хлором и озоном, восстановление перманганатов действием пероксида водорода, соляной кислоты, сернистого газа, сульфитов, спиртов, солями марганца(2). Большая часть диоксида марганца выделяется в виде бурого осадка, однако часть его остается в виде коллоидного раствора. Диоксид марганца как соединение промежуточной степени окисления проявляет окислительные и восстановительные свойства. Для него более характерно поведение окислителя. При нагревании происходит внутримолекулярная окислительно-восстановительная реакция, сопровождающаяся выделением кислорода и постепенным понижением степени окисления марганца с последовательным образованием разных оксидов. С сухим сероводородом реакция протекает очень быстро уже при комнатной температуре. При пропускании сероводорода через водную суспензию Мn0 2 образуется белесый осадок, состоящий из смеси сульфида марганца(2) и серы; в растворе присутствуют ионы S0 4- и S 2 0 2- .
Окислительные свойства диоксида марганца сильнее всего проявляются в сильнокислой среде. При обработке диоксида марганца холодной концентрированной соляной кислотой остается темный раствор, содержащий комплексную кислоту Н 2 [МпС1 6 ], а возможно, и невыделенный в индивидуальном виде тетрахлорид МnС1 4 . Постепенно раствор светлеет вследствие восстановления хлоридных
комплексов [МnС1 6 ] 2- -» [МnС1 6 ] 3- -> Mn 2+ + 6C1 - и выделения хлора.
В азотной и разбавленной серной кислотах Мn0 2 нерастворим, лишь при длительном хранении его под раствором кислоты наблюдается постепенное выделение кислорода вследствие окисления воды. Взаимодействие диоксида Мn0 2 с щелочами протекает лишь в концентрированных растворах и расплавах. В зависимости от температуры реакции, соотношения реагентов, наличия или отсутствия окислителей, например кислорода воздуха, образуются анионные оксоманганаты, содержащие марганец в разных степенях окисления от +3 до +6. Например, при взаимодействии диоксида марганца с горячим концентрированным раствором гидроксида калия в инертной атмосфере сначала образуется зеленый раствор манганата(4), который затем переходит в темно-синий раствор, содержащий эквимолярные количества манганата(5) и манганата(3). При проведении реакции на воздухе при температуре 350 - 450 °С образуется манганат(6), при температуре 600 -800 °С - манганат(5).
Гидроксиды.
Гидроксид марганца(2), выпадающий в виде белого (цвета слоновой кости) осадка при действии щелочей на водные растворы солей марганца(2) на воздухе быстро окисляется, поэтому его синтез ведут в инертной атмосфере. Более сильные окислители, такие как бромная вода, гипохлорит, переводят его в пиролюзит. В отличие от большинства гидроксидов переходных металлов гидроксид
марганца(2) имеет стехиометрический состав, отвечающий формуле Мn(ОН)2; он изоструктурен гидроксиду магния; является основанием средней силы, превосходящим аммиак, поэтому переходит в раствор не только при действии кислот, но и в присутствии ионов аммония.
Слабый амфотерный характер гидроксида Мn(2) проявляется в его способности образовывать анионные гидроксокомплексы: Мn(ОН) 2+ ОН - <-> [Мп(ОН) 3 ] -
Гидроксид марганца(3) образуется в виде бурого осадка переменного состава при окислении гидроксида марганца(2) кислородом воздуха. Первоначально образующийся продукт содержит атомы марганца в двух степенях окисления: +2 и +3 - и отвечает составу МпОх*nН 2 0.
При стоянии он превращается в форму оксогидроксида МnООН, известного в виде двух модификаций: ромбической (у-MnOOH, манганит) и моноклинной (а-MnOOH, гроутит). Оксогидроксид марганца(3) амфотерен.
Соли.
Взаимодействием гидроксида марганца(2) с кислотами получают разнообразные соли. В отличие от гидроксида все они устойчивы к окислению кислородом воздуха.
Соли марганца(2) образуют гидраты, окрашенные в бледно-розовый цвет, свойственный катионам [Мn(Н 2 0)6] 2+ . Они входят в состав некоторых гидратов, например MnS0 4 * 7H 2 0, Mn(C10 4) 2 *6Н 2 0, Mn(N0 3) 2 * 6Н 2 0. В водных растворах солей марганца(2) протекает гидролиз: [Мn(Н 2 0) 6 ] 2+ + Н 2 0 = [Мn(Н 2 0) 5 ОН] + + Н 3 0 +
Действие на растворы солей марганца сульфитами щелочных металлов приводит к осаждению основных солей, например NaMn 2 OH(S0 3) 2 (H 2 0).
При осаждении ионов Мn 2+ растворами сульфидов выпадает осадок гидратированого сульфида марганца(2) MnS *хН20 телесного цвета. Хотя кристаллическая структура этого продукта неизвестна, бледно-розовая окраска свидетельствует о том, что молекулы воды дополняют координационную сферу марганца до октаэдра. При хранении на воздухе осадок постепенно окисляется, превращаясь в бурый оксогидроксид МnООН, а в инертной атмосфере теряет кристаллизационную воду, приобретая зеленый цвет, свойственный природному минералу алабандину (α-MnS), имеющему струк
туру типа NaCl. Действием на раствор соли марганца дигидрофосфатом натрия в среде, близкой к нейтральной, удается осадить белый осадок среднего ортофосфата Мn 3 (Р0 4) 2 * 7Н 2 0.
В щелочной среде осаждаются основные соли, например Мn 2 (ОН)Р0 4 , Мn 5 (ОН) 4 (Р0 4) 2 .
Известны также различные кислые фосфаты, например Мn (Н 2 Р0 4) 2 *Н 2 0, хорошо растворимый в воде, и малорастворимый МnНР0 4 *Н 2 0. При действии на растворы солей марганца(2) раствором карбоната натрия выделяется белый осадок карбоната МnС0 3 , содержащий лишь незначительное количество основной соли. Чтобы избежать ее образования, осаждение проводят гидрокарбонатом.
Соли марганца (3)
При растворении МтООН на холоду в 70%-й серной кислоте образуется красный раствор, из которого могут быть выделены красные кристаллы. Наиболее распространенным методом получения солей марганца(3) служат окислительно-восстановительные превращения. Так, сульфат марганца(3) синтезируют анодным окислением горячего раствора сульфата марганца(2) в серной кислоте или восстановлением перманганата калия серной кислотой:
2KMn0 4 + 4H 2 S0 4 = Mn 2 (S0 4) 3 + K 2 S0 4 + 20 2 + 4H 2 0
Неорганические соли марганца(4) крайне неустойчивы и мало изучены. Так, сульфат марганца(4) Mn(S0 4) 2 выделяется в виде черных кристаллов из достаточно концентрированных сернокислых растворов сульфата марганца(2) при добавлении в них перманганата калия.
Соли марганца(6).
Впервые манганаты(6) приготовил И. Глаубер в
1659 г. при растворении пиролюзита в расплавленной селитре. Эти вещества представляют собой темно-зеленые, почти черные кристаллы, растворимые в растворах щелочей с образованием изумрудно-зеленых растворов.
В нейтральных и слабокислых растворах манганаты легко диспро-
порционируют, о чем судят по выпадению темно-коричневого осадка диоксида и появлению малинового окрашивания раствора. Для ускорения процесса обычно через раствор пропускают углекислый газ. Среди манганатов наибольшее значение имеет калийная соль К 2 Мn0 4 , служащая для производства перманганата КМ п 04. В лабораторных условиях манганаты щелочных металлов удобно получать
окислением воды перманганатом в сильнощелочном растворе. Для этого перманганат помещают в концентрированный раствор щелочи и нагревают.
Двуокись марганца - неорганическое соединение, оксид марганца (IV) с формулой MnO2. Встречается в естественном виде как широко распространенный минерал пиролюзит. В промышленности двуокись марганца получают электролизом раствора сульфата марганца, в лабораториях - из перманганата калия нагреванием или взаимодействием с пероксидом водорода.
Свойства
Тонкодисперсионный или мелкокристаллический порошок темно-коричневого или черного цвета. Не растворяется в воде. Разлагается при нагревании свыше +105 °С. Токсичен.
Химически реактив очень устойчив, считается самым стабильным кислородосодержащим соединением марганца. В нормальных условиях вступает в реакции слабо. Проявляет амфотерные свойства, т.е. образует как кислоты, так и щелочи. Может проявлять себя как восстановитель, но чаще как сильный окислитель. Реагирует с сильными неорганическими и органическими кислотами, такими как серная, соляная, азотная, щавелевая с образованием солей: сульфатов, хлоридов, нитратов, оксалатов. В реакции с соляной кислотой выделяется хлор. С азотной и серной кислотами - кислород. Взаимодействует с сильными окислителями. В реакциях со щелочами образует соли марганцовистой (Н2МпО3) кислоты - манганиты.
 |  |  |
| Марганец двуокись 91% ЭДМ |
Это интересно
- Человечество использует вещество практически с самого своего зарождения. Археологи установили, что наскальные рисунки из пещеры Ласко (Франция) нанесены именно двуокисью марганца. Этим рисункам, по данным радиоуглеродного анализа, от 17 до 19 тысяч лет.
- Есть и еще более древние свидетельства. В пещере Пеш-де-Лазе (Франция) найдены куски черного камня, являющегося диоксидом марганца. Эти камни, судя по всему, использовали неандертальцы для разжигания или поддержания огня около полумиллиона лет назад.
Меры предосторожности
Относится ко 2-му классу опасности для здоровья человека. Может попасть внутрь при вдыхании пылевого аэрозоля. Вызывает раздражение при контакте с кожей. При проглатывании или вдыхании накапливается в организме. Высокая доза попавшего в организм реактива оказывает негативное воздействие на органы дыхания, центральную нервную и сердечно-сосудистую системы. По правилам техники безопасности, установленных ГОСТом, при работе с диоксидом марганца следует использовать спецодежду, резиновые перчатки и респираторы типа «Лепесток» с противопылевым фильтром, защитные очки. В воздухе рабочей зоны следует регулярно проверять концентрацию реактива. Само помещение должно быть снабжено принудительной вентиляцией.
Хранят и транспортируют двуокись марганца во влагостойких мешках, бумажных с пропиткой или пластиковых, а также в стальных контейнерах и картонно-навивных барабанах. Хранят на крытых складах.
Применение

ОПРЕДЕЛЕНИЕ
Оксид марганца (IV) в обычных условиях представляет собой кристаллы черного цвета с коричневым оттенком, которые разлагаются при нагревании (рис. 1).
Брутто-формула - MnO 2 . Молярная масса оксида марганца (IV) равна 86,94 г/моль.
Рис. 1. Оксид марганца (IV). Внешний вид.
Не реагирует с водой. Из раствора осаждается гидрат MnO 2 ×nH 2 O. Переводится в раствор действием концентрированных кислот. Проявляет окислительно-восстановительные свойства. Является самым распространенным соединением марганца в природе.
Химическая формула оксида марганца 4
Химическая формула оксида марганца (IV) MnO 2 . Она показывает, что в состав данной молекулы входит один атом марганца (Ar = 55а.е.м) и два атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу оксида марганца (IV):
Mr(MnO 2) = Ar(Mn) + 2×Ar(O);
Mr(MnO 2) = 55 + 2×16 = 55 + 32 = 87.
Графическая (структурная) формула оксида марганца 4
Структурная (графическая) формула оксида марганца (IV) является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Примеры решения задач
ПРИМЕР 1
| Задание | Составьте формулы двух оксидов железа, если массовые доли железа в них 77,8% и 70,0%. |
| Решение |
Найдем массовую долю в каждом из оксидов меди: ω 1 (О) = 100% — ω 1 (Fe) = 100% — 77,8% = 22,2%; ω 2 (О) = 100% — ω 2 (Fe) = 100% — 70,0% = 30,0%. Обозначим количество моль элементов, входящих в состав соединения за «х» (железо) и «у» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева округлим до целых чисел): x:y = ω 1 (Fe)/Ar(Fe) : ω 1 (O)/Ar(O); x:y = 77,8/56: 22,2/16; x:y = 1,39: 1,39 = 1: 1. Значит формула первого оксида железа будет иметь вид FeO. x:y = ω 2 (Fe)/Ar(Fe) : ω 2 (O)/Ar(O); x:y = 70/56: 30/16; x:y = 1,25: 1,875 = 1: 1,5 = 2: 3. Значит формула второго оксида железа будет иметь вид Fe 2 O 3 . |
| Ответ | FeO, Fe 2 O 3 |
ПРИМЕР 2
| Задание | Составьте формулу соединения водорода, йода и кислорода, если массовые доли элементов в нём: ω(H) = 2,2%, ω(I) = 55,7%, ω(O) = 42,1%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Обозначим количество моль элементов, входящих в состав соединения за «х» (водород), «у» (йод), «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y:z = ω(H)/Ar(H) : ω(I)/Ar(I) : ω(O)/Ar(O); x:y:z= 2,2/1: 55,7/127: 42,1/16; x:y:z= 2,2: 0,44: 2,63 = 5: 1: 6. Значит формула соединения водорода, йода и кислорода будет иметь вид H 5 IO 6 . |
| Ответ | H 5 IO 6 |