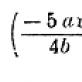Изомеры положения. Структурные изомеры - это что. История открытия изомерии
Ещё одним примером послужили винная и виноградная кислоты, после исследования которых Й. Берцелиус в ввел термин ИЗОМЕРИЯ и высказал предположение, что различия возникают из-за «различного распределения простых атомов в сложном атоме» (т. е. молекуле). Подлинное объяснение изомерия получила лишь во 2-й половине XIX в. на основе теории химического строения А. М. Бутлерова (структурная изомерия) и стереохимического учения Я. Г. Вант-Гоффа (пространственная изомерия).
Структурная изомерия
Структурная изомерия - результат различий в химическом строении. К этому типу относят:
Изомерия углеводородной цепи (углеродного скелета)
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример - бутан СН 3 -СН 2 -СН 2 -СН 3 и изобутан (СН 3) 3 СН. Др. примеры: антрацен и фенантрен (формулы I и II соответственно), циклобутан и метилциклопропан (III и IV).
Валентная изомерия

Валентная изомерия (особый вид структурной изомерии), при которой изомеры можно перевести друг в друга лишь за счет перераспределения связей. Например, валентными изомерами бензола (V) являются бициклогекса-2,5-диен(VI, «бензол Дьюара»), призман (VII, «бензол Ладенбурга»), бензвален (VIII).
Изомерия функциональной группы
Различается характером функциональной группы. Пример: Этанол (CH 3 -CH 2 -OH) и Диметиловый эфир (CH 3 -O-CH 3)
Изомерия положения
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или двойных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Пространственная изомерия (стереоизомерия)
Энантиомерия (оптическая изомерия)
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Этот тип изомеров подразделяют на энантиомерию (оптическую изомерию) и диастереомерию .
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с др. оптически активными веществами и физических свойств в хиральной среде). Необходимая и достаточная причина возникновения оптических антиподов - отнесение молекулы и одной из следующих точечных групп симметрии C n , D n , T, O, I (Хиральность). Чаще всего речь идет об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями, например:
Асимметрическими могут быть и др. атомы, например атомы кремния, азота , фосфора , серы . Наличие асимметрического атома не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллен (XI), 6,6"-динитро-2,2"-дифеновая кислота (XII). Причина оптическое активности последнего соединения - атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков , нуклеиновых кислот , гексагелицене (XIII).

(R)-, (S)- номенклатура оптических изомеров (правило наименования)
Четырём группам, присоединенным к ассиметрическому атому углерода C abcd , приписывается различное старшинство, отвечающее последовательности: a>b>c>d. В простейшем случае старшинство устанавливается по порядковому номеру атома, присоединенного к ассиметрическому атому углерода: Br(35), Cl(17), S(16), O(8), N(7), C(6), H(1).
Например, в бромхлоруксусной кислоте:

Старшинство заместителей при ассиметрическом атоме углерода следующее: Br(a), Cl(b), C группы COOH (c), H(d).
У бутанола-2 кислород является старшим заместителем (а), водород - младшим (d):

Требуется решить вопрос о заместителях CH 3 и CH 2 CH 3 . В этом случае старшинство определяется порядковым номером или номерами других атомов в группе. Первенство остается за этильной группой, так как в ней первый атом С связан с другим атомом С(6) и с другими атомами Н(1), тогда как в метильной группе углерод соединен с тремя атомами Н с порядковым номером 1. В более сложных случаях продлжают сравнивать все атомы, пока не доходят до атомов с различными порядковыми номерами. Если имеются двойная или тройная связи, то находящиеся при них атомы считаются соответственно за два и за три атома. Так, группу -COH рассматривают как С (O, O, H), а группу -COOH - как С(О, О, ОН); карбоксильная группа старше альдегидной, поскольку содержит три атома с порядковым номером 8.
В D-глицериновом альдегиде старшей является группа ОН(а), затем следует CHO(b), CH 2 OH(c) и Н(d):

Следующий этап заключается в определении, является ли расположение групп правым, R (лат. rectus), или левым, S (лат. sinister). Переходя к соответствующей модели, её ориентируют так, чтобы младшая группа (d) в перспективной формуле оказалась внизу, и затем рассматривают сверху вдоль оси, проходящей через заштрихованную грань тетраэдра и группу (d). В D-глицириновом альдегиде группы
расположены в направлении правого вращения, и следовательно, он имеет R-конфигурацию:

(R)-глицериновый альдегид
В отличие от D,L номенклатуры обозначения (R)- и (S)- изомеров заключают в скобки.
Диастереомерия
σ-диастереомерия
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ и π-диастереомеры. σ-диастериомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастериомеры являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:

Для некоторых типов диастереомерия введены специальные обозначения, например трео- и эритро-изомеры - это диастереомерия с двумя асимметрическим атомами углерода и пространств, расположением заместителей у этих атомов, напоминающим соотвующую треозу (родственные заместители находятся по разные стороны в проекционных формулах Фишера) и эритрозу (заместители - по одну сторону):

Эритро-изомеры, которых асимметрические атомы связаны с одинаковыми заместителями, называются мезо-формами. Они, в отличие от остальных σ-диастереомеров, оптически неактивны из-за внутримолекулярной компенсации вкладов во вращение плоскости поляризации света двух одинаковых асимметрических центров противоположной конфигурации. Пары диастереомеров, различающиеся конфигурацией одного из нескольких асимметрических атомов, называются эпимерами, например:

Термин «аномеры» обозначает пару диастереомерных моносахаридов, различающихся конфигурацией гликозидного атома в циклической форме, например аномерны α-D- и β-D-глюкозы.
π-диастереомерия (геометрическая изомерия)
π-диастериомерами, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).

Конформеры. Таутомеры
Явление неразрывно связано с температурными условиями его наблюдения. Так, например, хлорциклогексан при комнатной температуре существует в виде равновесной смеси двух конформеров - с экваториальной и аксиальной ориентацией атома хлора:

Однако при минус 150 °С можно выделить индивидуальную а-форму, которая ведет себя в этих условиях как устойчивый изомер.
С др. стороны, соединения, в обычных условиях являющиеся изомерами, при повышении температуры могут оказаться находящимися в равновесии таутомерами. Например, 1-бромпропан и 2-бромпропан - структурные изомеры, однако при повышении температуры до 250 °С между ними устанавливается равновесие, характерное для таутомеров.
Изомеры, превращающиеся друг в друга при температуре ниже комнатной, можно рассматривать как нежесткие молекулы.
Существование конформеров иногда обозначают термином «поворотная изомерия». Среди диенов различают s-цис- и s-транс - изомеры, которые, по существу, являются конформерами, возникающими в результате вращения вокруг простой (s-single) связи:

Изомерия также характерна для координационных соединений. Так, изомерны соединения, различающиеся по способу координации лигандов (ионизационная изомерия), например, изомерны:
SO 4 - и + Br -
Здесь, по существу, имеется аналогия со структурной изомерии органических соединений.
Химические превращения, в результате которых структурные изомеры превращаются друг в друга, называется изомеризацией. Такие процессы имеют важное значение в промышленности. Так, например, проводят изомеризацию нормальных алканов в изоалканы для повышения октанового числа моторных топлив; изомеризуют пентан в изопентан для последующего дегидрирования в изопрен. Изомеризацией являются и внутримолекулярной перегруппировки, из которых большое значение имеет, например, превращение оксима циклогексанона в капролактам - сырье для производства капрона.
В ходе урока вы получите общее представление о видах изомерии, узнаете, что такое изомер. Узнаете о видах изомерии в органической химии: структурной и пространственной (стереоизомерии). С помощью структурных формул веществ рассмотрите подвиды структурной изомерии (скелетную и изомерию положений), узнаете о разновидностях пространственной изомерии: геометрической и оптической.
Тема: Введение в органическую химию
Урок: Изомерия. Виды изомерии. Структурная изомерия, геометрическая, оптическая
Рассмотренные нами ранее виды формул, описывающих органические вещества, показывают, что одной молекулярной может соответствовать несколько разных структурных формул.
Например, молекулярной формуле C 2 H 6 O соответствуют два вещества с разными структурными формулами - этиловый спирт и диметиловый эфир. Рис. 1.
Этиловый спирт - жидкость, которая реагирует с металлическим натрием с выделением водорода, кипит при +78,5 0 С. При тех же условиях диметиловый эфир - газ, не реагирующий с натрием, кипит при -23 0 С.
Эти вещества отличаются своим строением - разным веществам соответствует одинаковая молекулярная формула.
Рис. 1. Межклассовая изомерия
Явление существования веществ, имеющих одинаковый состав, но разное строение и поэтому разные свойства называют изомерией (от греческих слов «изос» - «равный» и «мерос» - «часть», «доля»).
Типы изомерии
Существуют разные типы изомерии.
Структурная изомерия связана с разным порядком соединения атомов в молекуле.
Этанол и диметиловый эфир - структурные изомеры. Поскольку они относятся к разным классам органических соединений, такой вид структурной изомерии называется еще и межклассовой . Рис. 1.
Структурные изомеры могут быть и внутри одного класса соединений, например формуле C 5 H 12 соответствуют три разных углеводорода. Это изомерия углеродного скелета . Рис. 2.

Рис. 2 Примеры веществ - структурных изомеров
Существуют структурные изомеры с одинаковым углеродным скелетом, которые отличаются положением кратных связей (двойных и тройных) или атомов, замещающих водород. Этот вид структурной изомерии называется изомерией положения .
Рис. 3. Структурная изомерия положения
В молекулах, содержащих только одинарные связи, при комнатной температуре возможно почти свободное вращение фрагментов молекулы вокруг связей, и, например, все изображения формул 1,2-дихлорэтана равноценны. Рис. 4

Рис. 4. Положение атомов хлора вокруг одинарной связи
Если же вращение затруднено, например, в циклической молекуле или при двойной связи, то возникает геометрическая или цис-транс изомерия. В цис-изомерах заместители находятся по одну сторону плоскости цикла или двойной связи, в транс-изомерах - по разные стороны.
Цис-транс изомеры существуют в том случае, когда с атомом углерода связаны два разных заместителя. Рис. 5.



Рис. 5. Цис- и транс- изомеры
Еще один тип изомерии возникает в связи с тем, что атом углерода с четырьмя одинарными связями образует со своими заместителями пространственную структуру - тетраэдр. Если в молекуле есть хотя бы один углеродный атом, связанный с четырьмя разными заместителями, возникает оптическая изомерия . Такие молекулы не совпадают со своим зеркальным изображением. Это свойство называется хиральностью - от греческого с hier - «рука». Рис. 6. Оптическая изомерия характерна для многих молекул, входящих в состав живых организмов.
|
|
|
Рис. 6. Примеры оптических изомеров
Оптическая изомерия называется также энантиомерией (от греческого enantios - «противоположный» и meros - «часть»), а оптические изомеры - энантиомерами . Энантиомеры оптически активны, они вращают плоскость поляризации света на один и тот же угол, но в противоположные стороны: d- , или (+)-изомер, - вправо, l- , или (-)-изомер, - влево. Смесь равных количеств энантиомеров, называемая рацематом , оптически недеятельна и обозначается символом d,l- или (±).
Подведение итога урока
В ходе урока вы получили общее представление о видах изомерии, что такое изомер. Узнали о видах изомерии в органической химии: структурной и пространственной (стереоизомерии). С помощью структурных формул веществ рассмотрели подвиды структурной изомерии (скелетную и изомерию положений), познакомились с разновидностями пространственной изомерии: геометрической и оптической.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2008. - 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2010. - 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. - 4-е изд. - М.: РИА «Новая волна»: Издатель Умеренков, 2012. - 278 с.
Домашнее задание
1. №№ 1,2 (с.39) Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Почему число изомеров у углеводородов ряда этилена больше, чем предельных углеводородов?
3. Какие углеводороды имеют пространственные изомеры?
Изомеры - вещества с одинаковым составом молекулы, но разными химическим строением и свойствами.
Виды изомерии
I . Структурная – заключается в различной последовательности соединения атомов в цепи молекулы:
1) Изомерия цепи
Следует отметить, что атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным , с двумя другими атомами углерода – вторичным , с тремя – третичным , с четырьмя – четвертичным .
2) Изомерия положения
3) Изомерия межклассовая
4) Таутомерия
Таутомери́я (от греч. ταύτίς - тот же самый и μέρος - мера) - явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. При этом устанавливается таутомерное равновесие, и вещество одновременно содержит молекулы всех изомеров в определённом соотношении. Чаще всего при таутомеризации происходит перемещение атомов водорода от одного атома в молекуле к другому и обратно в одном и том же соединении.
Пример, таутомерные формы глюкозы:
1. Линейная форма глюкозы (альдегидоспирт)
2. Перегруппировка атомов и переход в циклические формы глюкозы (alha и beta)


II . Пространственная (стерео) – обусловлена различным положением атомов или групп относительно двойной связи или цикла, исключающих свободное вращение соединённых атомов углерода
Если атом углерода в молекуле
связан с четырьмя различными атомами или атомными группами, например:
то возможно существование двух соединений с одинаковой структурной формулой, но отличающихся пространственным строением. Молекулы таких соединений относятся друг к другу как предмет и его зеркальное изображение и являются пространственными изомерами.
Изомерия этого вида называется оптической, изомеры – оптическими изомерами или оптическими антиподами:
Молекулы оптических изомеров
несовместимы в пространстве (как левая и правая руки), в них отсутствует
плоскость симметрии.
Таким образом,
- оптическими изомерами называются пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптические изомеры аминокислоты
3. Конформационная изомерия
Следует отметить, что атомы и группы атомов, связанные друг с другом σ -связью, постоянно вращаются относительно оси связи, занимая различное положение в пространстве друг относительно друга.
Цель: знакомство с видами структурной и пространственной изомерии органических соединений.
План:
Классификация изомерии.
Структурная изомерия.
Пространственная изомерия
Оптическая изомерия
Первые попытки понять строение органических молекул относятся к началу XIX в. Впервые явление изомерии открыл Й. Берцелиус, а А. М. Бутлеров в 1861 г. предложил теорию химического строения органических соединений, которая объяснила явление изомерии.
Изомерия – существование соединений с одинаковым качественным и количественным составом, но разным строением или расположением их в пространстве, а сами вещества называются изомерами.
Классификация изомеров
Структурная
(различный порядок соединения атомов)
Стереоизомерия
(различное расположение атомов в пространстве)
Положения кратной связи
Положения функциональной группы
Конфигура
Конформа-
Структурная изомерия.
Структурные изомеры – это изомеры, имеющие одинаковый качественный и количественный состав, но отличающиеся химическим строением.
Структурная изомерия обуславливает многообразие органических соединений, в частности алканов. С увеличением числа атомов углерода в молекулах алканов быстро возрастает количество структурных изомеров. Так, для гексана (С 6 Н 14) оно равно 5, для нонана (С 9 Н 20) – 35.
Атомы углерода различаются по месту положения в цепи. Атом углерода, стоящий в начале цепи, связан с одним атомом углерода и называется первичным. Атом углерода, связанный с двумя атомами углерода – вторичным , с тремя – третичным , с четырьмя – четвертичным . В молекулах алканов с неразветвленной цепью содержатся только первичные и вторичные атомы углерода, а в молекулах алканов с разветвлённой цепью и третичные и четвертичные.
Виды структурной изомерии.

Метамеры – соединения, относящиеся к одному классу соединений, но имеющие различные радикалы:
Н 3 С – О – С 3 Н 7 – метилпропиловый эфир,
Н 5 С 2 – О – С 2 Н 5 – диэтиловый эфир
Межклассовая изомерия. При одном и том же качественном и количественном составе молекул, строение веществ различное.
Например: альдегиды изомерны кетонам:
Алкины – алкадиенам
Н 2 С = СН – СН = СН 2 бутадиен -1,3 НС = С - СН 2 – СН 3 – бутин-1
Структурная изомерия обусловливает и многообразие углеводородных радикалов. Изомерия радикалов начинается с пропана, для которого возможны два радикала. Если атом водорода отнять от первичного атома углерода, то получится радикал пропил (н-пропил). Если атом водорода отнять от вторичного атома углерода, то получится радикал изопропил
>> Химия: Изомерия и ее виды
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стерео-изомеры - расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода , образующими скелет молекулы. Как уже было показано, молекулярной формуле С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан.
С увеличением числа атомов углерода в молекуле число изомеров быстро растет. Для углеводорода С10Н22 их уже 75, а для углеводорода С20Н44 - 366 319.
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы:

Изомерия различных классов органических соединений (межклассовая изомерия) обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих разным классам. Так, молекулярной формуле С6В12 соответствует ненасыщенный углеводород гексен-1 и циклический циклогексан:
Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
Пространственная изомерия
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую.
Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис- и транс- обычно относят к паре одинаковых заместителей.
Геометрические изомеры различаются по физическим и химическим свойствам.
Оптическая изомерия возникает, если молекула несовместима со своим изображением в зеркале. Это возможно, когда у атома углерода в молекуле четыре различных заместителя. Этот атом называют асимметрическим. Примером такой молекулы является молекула а-аминопропионовой кислоты (а-аланин) СН3СН(КН2)СООН.
Как видно, молекула а-аланина ни при каком перемещении не может совпасть со своим зеркальным отображением. Такие пространственные изомеры называются зеркальными, оптическими антиподами, или энантиомерами. Все физические и практически все химические свойства таких изомеров идентичны.
Изучение оптической изомерии необходимо при рассмотрении многих реакций, протекающих в организме. Большинство этих реакций идет под действием ферментов - биологических катализаторов. Молекулы этих веществ должны подходить к молекулам соединений, на которые они действуют, как ключ к замку, следовательно, пространственное строение, взаимное расположение участков молекул и другие пространственные факторы имеют для течения этих реакций большое значение. Такие реакции называют стереоселективными.
Большинство природных соединений являются индивидуальными энантиомерами, и их биологическое действие (начиная от вкуса и запаха и кончая лекарственным действием) резко отличается от свойств их оптических антиподов, полученных в лаборатории. Подобное различие в биологической активности имеет огромное значение, так как лежит в основе важнейшего свойства всех живых организмов - обмена веществ .
Какие виды изомерии вы знаете?
Чем отличается структурная изомерия от пространственной?
Какие из предлагаемых соединений являются:
а) изомерами;
б) гомологами?
Дайте всем веществам названия.
4. Возможна ли геометрическая (цис-, транс) изомерия для: а) алканов; б) алкенов; в) алкинов; г) циклоалканов?
Объясните, приведите примеры.